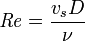Aqui os dejo la página web de la asignatura de bioquimica 2 ,de la USC , es supercompleta
http://aula.cesga.es/courses/BIOQUIMICAII/document/BioquimicaII/Bienvenida.html?cidReq=BIOQUIMICAII
Un blog sobre apuntes de Química principalmente y otros intereses que se pueden tener como universitario que estudia quimica en Santiago de Compostela. Se empezó este blog para dar respuestas a la gente a la hora de enfrentar la licenciatura. Con el sistema de grado puede que el contenido no se estructure de la misma forma
jueves, 23 de junio de 2011
domingo, 12 de junio de 2011
libros consulta on- line
Este post se va a ir modificando añadiendo libros que podeis ver on-line:
diccionario de quimica física, en google books: http://books.google.es/books?id=9_7xnVy4GzsC&printsec=frontcover&source=gbs_atb#v=onepage&q&f=false
Quimica general:"quimica la ciencia central": http://books.google.es/books?id=43qKhqwAoLgC&printsec=frontcover&source=gbs_atb#v=onepage&q&f=false
Ingeniería química: operaciones básicas : http://books.google.es/books?id=qsIH0zrUIMEC&printsec=frontcover&source=gbs_atb#v=onepage&q&f=falsehttp://books.google.es/books?id=qsIH0zrUIMEC&printsec=frontcover&source=gbs_atb#v=onepage&q&f=false
diccionario de quimica física, en google books: http://books.google.es/books?id=9_7xnVy4GzsC&printsec=frontcover&source=gbs_atb#v=onepage&q&f=false
Quimica general:"quimica la ciencia central": http://books.google.es/books?id=43qKhqwAoLgC&printsec=frontcover&source=gbs_atb#v=onepage&q&f=false
Ingeniería química: operaciones básicas : http://books.google.es/books?id=qsIH0zrUIMEC&printsec=frontcover&source=gbs_atb#v=onepage&q&f=falsehttp://books.google.es/books?id=qsIH0zrUIMEC&printsec=frontcover&source=gbs_atb#v=onepage&q&f=false
sábado, 11 de junio de 2011
proceso frasch

http://www.textoscientificos.com/quimica/azufre/proceso-azufre-frasch
Este procedimiento produce azufre elemental, que no requería una mayor purificación. Sin embargo, debido a un número limitado de tales depósitos de azufre y el alto costo de trabajar ellos, este proceso de extracción de azufre no se ha utilizado de una manera importante en cualquier parte del mundo, desde el año 2002.
La mayor cantidad del azufre elemental del mundo se ha obtenido por el proceso de Frasch a partir de las piedras calizas porosas que lo contienen. Hermán Fransch desarrolló su ingenioso método, que consiste en fundir el azufre bajo tierra o el mar, y luego bombearlo hasta la superficie. Se utiliza equipo común de los pozos petroleros para hacer las perforaciones hasta el fondo de los estratos cargados de azufre, a una profundidad entre 150 y 750 m bajo tierra.
Se introduce un juego de tres tubos concéntricos, se pasa un tubo de 10 cm a través del de 20 cm, de modo que quede un espacio anular entre los dos, extendiéndolo casi hasta el fondo de la roca cargada de azufre, y se le apoya en un collar que sella el espacio anular entre los tubos de 20 y 10 cm. Un tubo para aire, de 3 cm de diámetro, dentro de los otros, llega hasta una profundidad ligeramente por encima del collar mencionado. El tubo de 20 cm se perfora en dos niveles diferentes, uno encima y otro debajo del collar anular. El conjunto superior de perforaciones permite que escape el agua caliente, y el azufre fundido entra al sistema a través de las perforaciones inferiores.
Se pasa agua caliente a más o menos 160°C (punto de fusión del azufre 115°C) hacia abajo del espacio anular, entre los tubos de 20 y 10 cm y se hace entrar aire comprimido hacia abajo del tubo de 3 cm para que el azufre líquido pueda subir a la superficie.
Más info sobre azufre:
http://www.textoscientificos.com/quimica/azufre
http://html.rincondelvago.com/azufre.html
jueves, 9 de junio de 2011
oxido nitrico

Esta sustancia es un gas paramagnético
El paramagnetismo es la tendencia de los momentos magnéticos libres (espín u orbitales) a alinearse paralelamente a un campo magnético.
se sintetiza industrialmente a partir del amoniaco y el oxigeno molecular:
4 NH3 + 5 O2 → 4 NO + 6 H2O
En el laboratorio se genera normalmente por reducción de ácido nitrico con cobre al 50%
8 HNO3 + 3 Cu → 3 Cu(NO3)2 + 4 H2O + 2 NO
El NO se oxida facilmente a NO2, se puede apreciar al exponer el NO , que es incoloro, al aire unas nubes café-rojizas que son NO2
2NO +O2--> 2NO2
Pero en un recipiente hermético es muy estable.Cuando se enfría y se licua o solidifica muestra tendencia a formar N2O2.
El NO pierde con facilidad su electrón del orbital de antienlace para formar el ión nitrosilo NO+ que es diamagnético y tiene una longitud de enlace N-O menor.
El diamagnetismo es una propiedad de los materiales que consiste en ser repelidos por los imanes.
Las sustancias, en su gran mayoría, son diamagnéticas, puesto que todos los pares de electrones con espín opuesto contribuyen débilmente al diamagnetismo, y sólo en los casos en los que hay electrones desparejados existe una contribución paramagnética (o más compleja) en sentido contrario.
miércoles, 8 de junio de 2011
propelente
Buscando está palabra para una mejor comprensión del concepto , descubri que para la RAE, no existe.
Os dejo algunas definiciones:
-un fluido capaz de ejercer presión al estar contenido en un recipiente cerrado a temperatura ambiente. Los propelentes proveen la energía capaz de expeler el contenido, influyendo en la forma en la cual el producto es descargado pudiendo ser espumas, nieblas
-una sustancia capaz de expeler el contenido de un aerosol a través de la válvula cuando ésta es actuada.
Os dejo algunas definiciones:
-un fluido capaz de ejercer presión al estar contenido en un recipiente cerrado a temperatura ambiente. Los propelentes proveen la energía capaz de expeler el contenido, influyendo en la forma en la cual el producto es descargado pudiendo ser espumas, nieblas
-una sustancia capaz de expeler el contenido de un aerosol a través de la válvula cuando ésta es actuada.
martes, 7 de junio de 2011
aluminio
Su numero atómico es el 13 y pertenece a la familia del Boro.Los 13 protones que forman el núcleo están rodeados de 13 electrones dispuestos en la forma:
1s22s22p63s23p1
Existen en la naturaleza dos isótopos de este elemento, el 27Al y el 26Al. El primero de ellos es estable mientras que el segundo es radiactivo y su vida media es de 7,2×105 años.Al igual que el 14C, la medida de las abundancias del 26Al es utilizada en técnicas de datación
Se trata de un metal no ferroso. En estado natural se encuentra en muchos silicatos. Como mineral se extrae del mineral conocido como bauxita,(recibe su nombre de la localidad francesa de Les Baux, donde fue extraída por primera vez. Actualmente los principales yacimientos se encuentran en el Caribe, Australia, Brasil y África)por transformación mediante el proceso Bayer y a continuación en aluminio mediante electrólisis.
Tiene unas propiedades que lo hacen muy útil en ingeniería mecánica, tales como su baja densidad y su alta resistencia a la corrosión. Es un buen conductor de la electricidad, se mecaniza con facilidad y es relativamente barato. Por todo ello, es el metal que más se utiliza después del acero.
Es un metal con un gran potencial de reducción estándar negativo y, como es de esperar, es muy reactivo.
Cualquier superficie expuesta de aluminio metálico reacciona rápidamente con el oxígeno para formar óxido de aluminio Al2O3. En estas condiciones, una capa impermeable de óxido, de entre 10 -4 y 10 -6 mm de espesor, protege las capas de átomos de Al subyacentes. Esto sucede porque el ión oxígeno tiene un radio similar al del átomo de Al.
El especial atractivo del aluminio es su baja densidad, que solo supera el magnesio
(si no tenemos en cuenta a los metales alcalinos muy reactivos)
El aluminio es buen conductor del calor, propiedad que explica su uso en utensilios de cocina; sin embargo, no es tan bueno como el cobre. También es excepcional como conductor de la electricidad. El problema principal que plantea su uso en el cableado doméstico está en las conexiones. Si el aluminio se une al cobre, se establece una celda electroquímica en condiciones de humedad, que hace que se produzca la oxidación del aluminio.
- Propiedades químicas del aluminio
1. Arde con llama cuando está pulverizado dando óxido de aluminio
2. Arde de forma exotérmica con los halógenos
3. Es un metal anfótero
4. Las soluciones de sales de aluminio son ácidas
Producción
El aluminio es el metal más abundante de la corteza terrestre, principalmente en forma de arcillas. Pero extraerlo no es rentable. En los ambientes cálidos y húmedos los iones más solubles son lixiviados de la estructura de la arcilla para dejar el mineral bauxita.
La primera etapa del proceso de extracción es la purificación de la bauxita.
Esto se consigue mediante la digestión del mineral triturado con solución de hidróxido de sodio caliente para dar el ion aluminato soluble:
Al2O3(s) + 2OH-(ac)+3 H2O -----> 2 [ Al(OH)4] – (ac)
Los materiales insolubles, en especial el óxido de hierro (III) se eliminan por filtración en forma de “lodo rojo”.
Al enfriarse la solución, en equilibrio se desplaza hacia la izquierda y se precipita el trihidrato de óxido de aluminio, en tanto que, las impurezas quedan en solución:
2 [ Al(OH)4] – (ac)-----> Al2O3•3H2O(g)
Para electrolizar el óxido de aluminio era necesario encontrar un compuesto de aluminio con un punto de fusión más bajo, como el mineral criolita(Na3 AlF6), hay pocos depósitos de este mineral. Debido a su escasez casi toda la criolita se fabrica.
El óxido de aluminio se disuelve en la criolita fundida alrededor de 950ºC. El aluminio fundido se produce en el cátodo y el oxígeno que se forma en el ánodo oxida el carbono a monóxido de carbono.
Al3+( Na3 AlF6) + 3 é ----> Al (l)
O2-( Na3 AlF6) + C ---->CO (g) + 2 é
El proceso consume mucha energía.
La producción de aluminio genera 4 productos secundarios que crean importantes problemas de contaminación:
1- Lodo rojo: que se produce en la purificación de la bauxita y es fuertemente básico
2- Fluoruro de hidrógeno gaseoso: que se produce cuando la criolita reacciona con los rastros de humedad del óxido de aluminio.
3- Óxidos de carbono: que se producen en el ánodo
4- Fluorocarbonos,:que se producen por reacción del flúor con el ánodo de carbono.
El aluminio es 100% reciclable sin merma de sus cualidades físicas, y su recuperación por medio del reciclaje se ha convertido en un faceta importante de la industria del aluminio. El proceso de reciclaje del aluminio necesita poca energía.
Aqui teneis un video de la producción de Aluminio :
http://www.youtube.com/watch?v=CGDV_v-aiRU
1s22s22p63s23p1
Existen en la naturaleza dos isótopos de este elemento, el 27Al y el 26Al. El primero de ellos es estable mientras que el segundo es radiactivo y su vida media es de 7,2×105 años.Al igual que el 14C, la medida de las abundancias del 26Al es utilizada en técnicas de datación
Se trata de un metal no ferroso. En estado natural se encuentra en muchos silicatos. Como mineral se extrae del mineral conocido como bauxita,(recibe su nombre de la localidad francesa de Les Baux, donde fue extraída por primera vez. Actualmente los principales yacimientos se encuentran en el Caribe, Australia, Brasil y África)por transformación mediante el proceso Bayer y a continuación en aluminio mediante electrólisis.
Tiene unas propiedades que lo hacen muy útil en ingeniería mecánica, tales como su baja densidad y su alta resistencia a la corrosión. Es un buen conductor de la electricidad, se mecaniza con facilidad y es relativamente barato. Por todo ello, es el metal que más se utiliza después del acero.
Es un metal con un gran potencial de reducción estándar negativo y, como es de esperar, es muy reactivo.
Cualquier superficie expuesta de aluminio metálico reacciona rápidamente con el oxígeno para formar óxido de aluminio Al2O3. En estas condiciones, una capa impermeable de óxido, de entre 10 -4 y 10 -6 mm de espesor, protege las capas de átomos de Al subyacentes. Esto sucede porque el ión oxígeno tiene un radio similar al del átomo de Al.
El especial atractivo del aluminio es su baja densidad, que solo supera el magnesio
(si no tenemos en cuenta a los metales alcalinos muy reactivos)
El aluminio es buen conductor del calor, propiedad que explica su uso en utensilios de cocina; sin embargo, no es tan bueno como el cobre. También es excepcional como conductor de la electricidad. El problema principal que plantea su uso en el cableado doméstico está en las conexiones. Si el aluminio se une al cobre, se establece una celda electroquímica en condiciones de humedad, que hace que se produzca la oxidación del aluminio.
- Propiedades químicas del aluminio
1. Arde con llama cuando está pulverizado dando óxido de aluminio
2. Arde de forma exotérmica con los halógenos
3. Es un metal anfótero
4. Las soluciones de sales de aluminio son ácidas
Producción
El aluminio es el metal más abundante de la corteza terrestre, principalmente en forma de arcillas. Pero extraerlo no es rentable. En los ambientes cálidos y húmedos los iones más solubles son lixiviados de la estructura de la arcilla para dejar el mineral bauxita.
La primera etapa del proceso de extracción es la purificación de la bauxita.
Esto se consigue mediante la digestión del mineral triturado con solución de hidróxido de sodio caliente para dar el ion aluminato soluble:
Al2O3(s) + 2OH-(ac)+3 H2O -----> 2 [ Al(OH)4] – (ac)
Los materiales insolubles, en especial el óxido de hierro (III) se eliminan por filtración en forma de “lodo rojo”.
Al enfriarse la solución, en equilibrio se desplaza hacia la izquierda y se precipita el trihidrato de óxido de aluminio, en tanto que, las impurezas quedan en solución:
2 [ Al(OH)4] – (ac)-----> Al2O3•3H2O(g)
Para electrolizar el óxido de aluminio era necesario encontrar un compuesto de aluminio con un punto de fusión más bajo, como el mineral criolita(Na3 AlF6), hay pocos depósitos de este mineral. Debido a su escasez casi toda la criolita se fabrica.
El óxido de aluminio se disuelve en la criolita fundida alrededor de 950ºC. El aluminio fundido se produce en el cátodo y el oxígeno que se forma en el ánodo oxida el carbono a monóxido de carbono.
Al3+( Na3 AlF6) + 3 é ----> Al (l)
O2-( Na3 AlF6) + C ---->CO (g) + 2 é
El proceso consume mucha energía.
La producción de aluminio genera 4 productos secundarios que crean importantes problemas de contaminación:
1- Lodo rojo: que se produce en la purificación de la bauxita y es fuertemente básico
2- Fluoruro de hidrógeno gaseoso: que se produce cuando la criolita reacciona con los rastros de humedad del óxido de aluminio.
3- Óxidos de carbono: que se producen en el ánodo
4- Fluorocarbonos,:que se producen por reacción del flúor con el ánodo de carbono.
El aluminio es 100% reciclable sin merma de sus cualidades físicas, y su recuperación por medio del reciclaje se ha convertido en un faceta importante de la industria del aluminio. El proceso de reciclaje del aluminio necesita poca energía.
Aqui teneis un video de la producción de Aluminio :
http://www.youtube.com/watch?v=CGDV_v-aiRU
Reynolds ( ese gran amigo de Chenlo)
A partir de la wikipedia : El número de Reynolds (Re) es un número adimensional utilizado en mecánica de fluidos, diseño de reactores y fenómenos de transporte para caracterizar el movimiento de un fluido.
Dejando a parte la Wiki...
Osbourne Reynolds realizó un experimento en 1883 que es el punto de arranque experimental en el que se fundamenta el estudio de los regimenes de circulación.
La situación experimental consiste en hacer circular un líquido a distintas velocidades por el interior de una conducción recta y transparente.La inyección de un colorante en un punto de la conducción permite visualizar los cambios cualitativos que se originan en el líquido que circula por ella al variar el caudal y la velocidad media v=q/S, de un experimento a otro.
Si la velocidad del líquido es baja el filamento del líquido mantiene la forma a lo largo del recorrido, al aumentar la velocidad el filamento coloreado se ondula y a partir de cierto valor, se rompe e inunda transversalmente la conducción.
El modulo de Reynolds reune las magnitudes que caracterizan el fenómeno de la circulación,delimita los diferentes regímenes y sirve de base para otros fenómenos de algún modo relacionados con la circulación de fluidos.
El módulo de Reynolds nos da una idea de la relación entre fuerzas inerciales y fuerzas viscosas que actúan en el seno de un fluido
Re: Fuerzas inerciales/ fuerzas viscosas
Las fuerzas inerciales facilitan el movimiento y las viscosas ofrecen resistencia.
Cuando hablamos de tuberías :
Si Re<2100 el régimen se considera laminar
y si Re> 4000 el régimen se considera turbulento
para ampliar info ,aqui os dejo un link de un libro on-line : http://books.google.es/books?id=XZNYpvnO_V8C&lpg=PA213&dq=modulo%20de%20reynolds&pg=PA214#v=onepage&q&f=false
El número de Reynolds relaciona la densidad, viscosidad, velocidad y dimensión típica de un flujo en una expresión adimensional, que interviene en numerosos problemas de dinámica de fluidos. Desde un punto de vista matemático el número de Reynolds de un problema o situación concreta se define por medio de la siguiente fórmula:
o equivalentemente por:
donde:
- ρ: densidad del fluido
- vs: velocidad característica del fluido
- D: diámetro de la tubería a través de la cual circula el fluido o longitud característica del sistema
- μ: viscosidad dinámica del fluido
- ν: viscosidad cinemática del fluido
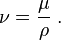
Dejando a parte la Wiki...
Osbourne Reynolds realizó un experimento en 1883 que es el punto de arranque experimental en el que se fundamenta el estudio de los regimenes de circulación.
La situación experimental consiste en hacer circular un líquido a distintas velocidades por el interior de una conducción recta y transparente.La inyección de un colorante en un punto de la conducción permite visualizar los cambios cualitativos que se originan en el líquido que circula por ella al variar el caudal y la velocidad media v=q/S, de un experimento a otro.
Si la velocidad del líquido es baja el filamento del líquido mantiene la forma a lo largo del recorrido, al aumentar la velocidad el filamento coloreado se ondula y a partir de cierto valor, se rompe e inunda transversalmente la conducción.
El modulo de Reynolds reune las magnitudes que caracterizan el fenómeno de la circulación,delimita los diferentes regímenes y sirve de base para otros fenómenos de algún modo relacionados con la circulación de fluidos.
El módulo de Reynolds nos da una idea de la relación entre fuerzas inerciales y fuerzas viscosas que actúan en el seno de un fluido
Re: Fuerzas inerciales/ fuerzas viscosas
Las fuerzas inerciales facilitan el movimiento y las viscosas ofrecen resistencia.
Cuando hablamos de tuberías :
Si Re<2100 el régimen se considera laminar
y si Re> 4000 el régimen se considera turbulento
para ampliar info ,aqui os dejo un link de un libro on-line : http://books.google.es/books?id=XZNYpvnO_V8C&lpg=PA213&dq=modulo%20de%20reynolds&pg=PA214#v=onepage&q&f=false
Suscribirse a:
Entradas (Atom)